

蛙皮素受体亚型-3(bombesin receptor subtype 3, BRS-3,也称BB3)是孤儿受体,与胃泌素释放肽受体(gastrin-releasing peptide receptor, GRPR,也称BB1)和神经介素B受体(neuromedin B receptor,NMBR,也称BB2)同属于蛙皮素样受体(bombesin-like peptide receptor)家族。尽管与BB1和BB2分别有51%和47%的序列同源性,但已有研究表明BRS-3具有独特的药理作用,导致其对所有已知的天然蛙皮素样肽的亲和力都非常微弱;同时,内生配体的缺乏,给BRS-3在生理病理功能方面的研究带来极大阻碍。尽管如此,BRS-3受体长期受到工业界和学术界的关注,这与其所表现出的调节体内能量代谢平衡和葡萄糖稳态密切相关,使其有望成为治疗II型糖尿病的新型靶点。虽然已报道的BRS-3激动剂可以降低实验动物的体重并调节其血糖稳态,但是由于这些激动剂能够同时激动脑中的BRS-3,存在潜在的心血管方面的副作用。因此,亟需发现新的外源性配体对BRS-3进行概念验证研究,更加全面、充分地对BRS-3进行靶点确证,探究仅激动外周BRS-3的激动剂是否可以改善糖尿病模型小鼠的血糖稳态。
在前期BRS-3配体及功能的研究基础上(Cellular and Molecular Life Sciences 2022, 79, 72; Phytomedicine 2022, 100, 154085; Journal of Proteome Research 2020, 19, 1513-1521),必赢766net手机版张岩课题组联合必赢766net手机版李绍顺教授团队、生命科学技术学院肖华教授团队,发展了一系列含萘醌肟结构新型骨架的BRS-3选择性小分子激动剂,其中DSO-5a激动效果最强(IP-1测试中EC50≈3.8 nM),并可有效改善正常小鼠和糖尿病db/db小鼠的血糖稳态。药代动力学表明,DSO-5a穿过血脑屏障能力差,表明作用于外周BRS-3受体的小分子激动剂仍可以调节体内血糖稳态,并可能避免作用于中枢带来的副作用。进一步采用DSO-5a作为分子探针,通过定量蛋白质组学方法研究了BRS-3介导的信号通路,发现PPAR-gamma是一种由BRS-3介导的新型信号通路,对于调节体内葡萄糖稳态可能发挥着重要作用。该研究成果为II型糖尿病新型靶点的确认以及治疗提供了新策略。
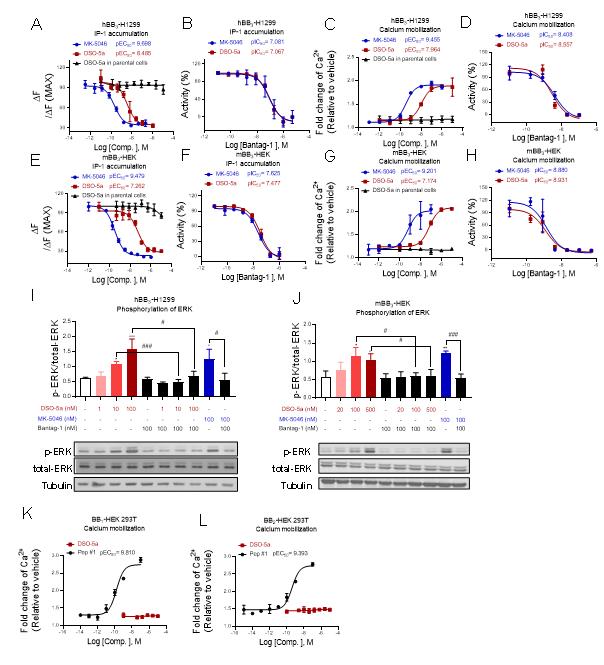
图1: DSO-5a细胞水平特异性激动BRS-3(BB3)受体
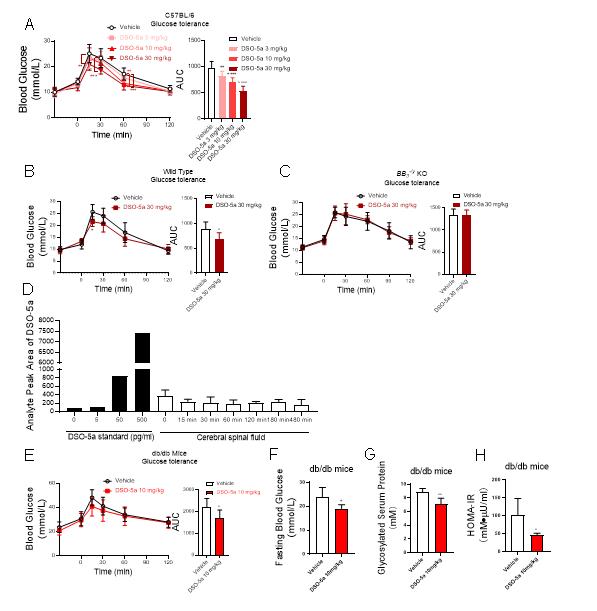
图2:DSO-5a在动物体内改善血糖稳态
近日,相关研究工作以“Discovery of Dimethyl Shikonin Oxime 5a, a Potent, Selective Bombesin Receptor Subtype-3 Agonist for the Treatment of Type 2 Diabetes Mellitus”为题在线发表在药物化学国际知名期刊Journal of Medicinal Chemistry上。该论文通讯作者为必赢766net手机版张岩副教授和必赢766net手机版生命科学技术学院肖华教授。该论文的共同第一作者为必赢766net手机版研究生吴乐昊(已赴美国普渡大学继续深造)、必赢766net手机版化学化工学院崔家华助理研究员。该研究得到必赢766net手机版李绍顺教授和化学化工学院贾金平教授的支持。
该研究工作得到了上海市自然科学基金、国家重点研发计划、国家自然科学基金等项目资助。
论文链接:https://pubs.acs.org/doi/full/10.1021/acs.jmedchem.3c00323